감압병(Decompression sickness) 원인과 발행되는 화학적 구조로 설명해봅니다.
공기중의 산소와 진로의 혼합비
일반적인 공기는 질소와 산소로 구성되어있다. 질소의 비율이 약 79%이며 산소의 비율은 21%입니다.
이러한 공기를 압축해서 심해다이버의 공기통(흔히 산소통이라고 합니다)의 내용은 잠수깊에에 따라서 질소와 산소의 비율이 달라집니다.
가스통의 종류
혼합 가스는 다이빙의 환경과 수심에 따라서 질소와 산소, 헬륨을 조합하여 사용합니다. 그중에서 대표적으로 사용되는 종류는 나이트록스(Nitrox)와 트라이믹스 (Trimix)입니다.
나이트록스
나이트록스는 산소(O)와 질소(N)의 비율을 조절하여 사용되는 가스입니다.
공기의 (21:78) 비율보다 더 높은 산소를 사용하며 나이트록스를 표기할때는 Enriched Air Nitrox의 첫글자를 모아서 EAN이라고 표기합니다.
나이트록스의 한 종류인 EAN32의 뜻은 산소를 32%, 68%의 질소로 구성되어있다는 것을 나타냅니다.
산소 함량이 높아질수록 다이빙 시간을 연장할 수 있지만, 산소 중독 위험도 함께 증가합니다.
일반적으로 나이트록스의 경우 가장많이 사용되는 잠수가스이며, 잘소의 함유량이 낮기에 상대적으로 감압병의 발생도 안전규칙만 지켜지다면 큰 문제는 발생되지 않는다.
트라이믹스
더 깊은 심해잠수를 할 경우에는 트라이믹스 가스를 사용합니다
트라이믹스는 추가로 헬륨을 포함합니다. 헬륨은 질소에 비해 더 낮은 밀도를 가지고 있어 고압 다이빙에 적합합니다. 헬륨을 함유한 트라이믹스는 다이빙 심도에 따라 산소, 헬륨, 질소의 비율이 조절됩니다.
기본적으로 수심 10m 증가시 기압은 1기압씩 증가됩니다.
따라서 수평면위에 산소의 비율이 21%라고 하면 10M 증가시마다 산소의 비중은 21씩 증가됨을 보여줍니다. 따라서 산소중독의 가능성은 증가합니다.
이를 방지하기 위해서 헬륨가스를 추가하여서 과산소의 중추신경계 중독을 방지할 수 있습니다.
|
수심
|
기압
|
공기(산소21%)
|
트라이믹스(산소12%)
|
|
0
|
1
|
0.21
|
0.12
|
|
10
|
2
|
0.42
|
0.24
|
|
20
|
3
|
0.63
|
0.36
|
|
30
|
4
|
0.84
|
0.48
|
|
40
|
5
|
1.05
|
0.60
|
|
50
|
6
|
1.26
|
0.72
|
산소중독과 중추신경계의 반응

산소 중독은 중추 신경계에서 발생하는 생명과학의 메커니즘으로 설명하면 다음과 같습니다.
산소 중독은 과도한 산소 노출로 인해 중추 신경계에 부정적인 영향을 미치는 상태를 말합니다. 산소는 우리 몸에서 에너지 생산에 필요한 기본적인 요소이지만, 과도한 양의 산소는 중추 신경계를 자극하고 손상시킬 수 있습니다.
산소 화학적 반응: 산소는 중추 신경계의 뉴런에서 화학적 반응을 일으킬 수 있습니다. 과도한 양의 산소가 중추 신경계로 공급될 경우, 산소 분자는 뉴런 내부의 화학적 구성요소와 상호작용하면서 손상을 일으킬 수 있습니다. 이러한 화학적 반응은 뉴런의 기능을 저하시키고 중추 신경계의 안정성을 어렵게 만들 수 있습니다.
산소 활성화 및 산화 스트레스: 과도한 양의 산소는 산소 분자 자체가 활성화되어 산화 스트레스를 유발할 수 있습니다. 산화 스트레스는 뉴런 내부의 산소에 의한 자유 라디칼 형성을 촉진시키고, 산소로 인한 산화 작용이 세포 내부의 구성 요소를 손상시킴으로써 중추 신경계에 부정적인 영향을 미칩니다.
염증 반응: 산소 중독은 또한 염증 반응을 유발할 수 있습니다. 과도한 양의 산소는 염증 인자의 증가와 면역 반응을 활성화시키는 경로를 통해 중추 신경계에 염증을 유발할 수 있습니다. 이러한 염증 반응은 뉴런의 손상과 염증성 질환의 발생을 초래할 수 있습니다.
감압병을 보일의 법칙과 헨리의 법칙으로 설명해봅니다.
보일의 법칙이란?
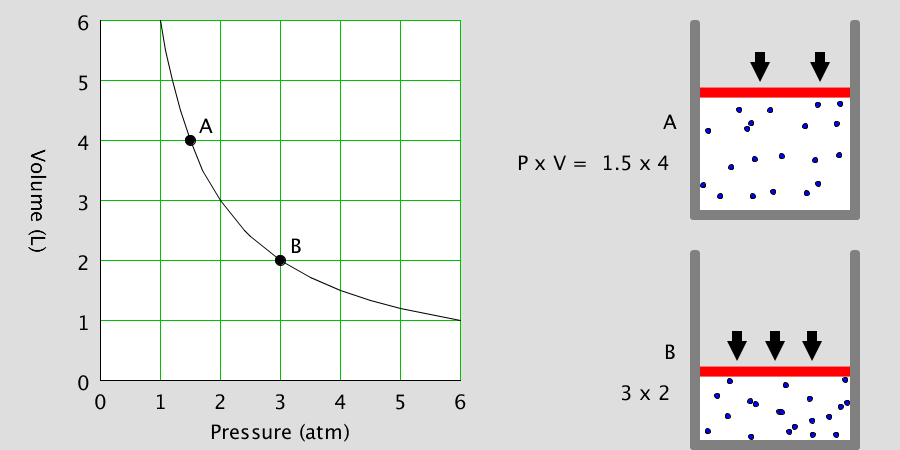
보일의 법칙에 따르면, 온도가 일정한 상태에서 기체의 압력과 부피는 서로 반비례적인 관계에 있습니다.
보일의 법칙은 다음과 같이 표현될 수 있습니다: P₁V₁ = P₂V₂
여기서 P₁과 V₁은 초기 상태의 압력과 부피를 나타내고, P₂와 V₂는 변화한 상태의 압력과 부피를 나타냅니다. 즉, 압력과 부피의 곱은 일정하다는 것을 의미합니다.
예를 들어, 기체의 부피를 줄이면 압력이 증가하고, 부피를 확대하면 압력이 감소합니다. 이는 기체 분자들이 서로 밀집하게 모여든다면 압력이 증가하고, 분자들이 희박하게 퍼져있다면 압력이 감소하기 때문입니다.
헨리의 법칙

헨리의 법칙은 기체와 액체 사이의 용해도를 설명하는 물리적인 법칙입니다. 헨리의 법칙에 따르면, 일정한 온도와 압력에서 기체의 용해도는 기체의 부분압력에 비례한다는 법칙입니다.
헨리의 법칙은 다음과 같이 표현될 수 있습니다:
p=k*c
여기서 p(atm)는 용액 위에 있는 기체의 분압, c(mol/L)는 용질의 농도, k(L·atm/mol)는 농도위아력의 상수이다.
이 상수는 헨리의 상수로도 알려져 있는데, 용매, 용질, 온도에 따라 결정된다.
헨리의 법칙은 용액과 기체 사이의 상호 작용을 설명합니다. 기체 분자는 액체 용질과 상호 작용하여 액체 내에 용해될 수 있습니다. 이 때, 기체의 분압이 높을수록 액체에 용해되는 기체의 농도도 증가합니다.
탄산음료를 헨리의 법칙에 따라서 설명한다면 음료안에 있는 이산화탄소의 분압이 증가하면 음료 내에 용해된 이산화탄소의 농도도 증가합니다.
따라서 탄산음료를 개봉하거나 흔들면 기체 분압이 변하고, 이로 인해 기체가 용액으로부터 방출되어 거품이 생성됩니다.
보일의 법칙과 헨리의 법칙으로 감압병을 설명해봅니다.
감압병은 기압이 급격히 변하하여 체내에 흡수된 질소가 과도하게 분출되어서 기포를 형성해서 발생되는 현상입니다.
호흡을 통해서 산소통에서 산소와 질소를 흡수합니다. 산소는 신진대사에 사용되지만 질소는 혈관안에 용해되어 그대로 있다가 배출됩니다.
따라서 급격한 기압차이가 발생되면 빠른속도로 질소가 배출되어서 기포가 형성, 과포화상태로 진행됩니다.
보일의 법칙으로 설명하면 해수면(1기압)에서 수심 10m (2기압)으로 50% 기체의 부피가 감소하고 30m(4기압)으로 25% 감소, 70m(8기압)으로 12.5% 감소합니다.
따라서 심해보다는 빠른속도로 상승할때 해수면 근처에서 감압병이 발생되는 현상이 나옵니다.
심해잠수시 해수면 근처에오면 심리적으로 빠른상승을 하고싶다는 심리적인 압박감으로 감압병이 발생됩니다.
이번 보고서는 생명과학에서 기본적인 이론인 보일의 법칙과 헨리의 법칙에 대해서 기초적인 내용을 다시한번 살펴보는 시간이었고, 기본에 충실한 자연과학도의 모습을 일반 현상에서 비교하는 아이디어입니다.
더 세부적이고 전문적인 내용을 포함하여 작성하시기 바랍니다